草酸二甲酯催化制备碳酸二甲酯反应过程研究
时间:2024-05-27 来源:中国煤炭杂志官网 分享:清洁利用
草酸二甲酯催化制备碳酸二甲酯反应过程研究
“双碳”背景下,以煤炭为原料的化工产品各方面核查都更加严格,煤化工企业绿色低碳转型升级迫在眉睫。目前我国煤制甲醇产能约1亿t,国内甲醇市场低迷,盈利能力不强;随着近期大型煤制甲醇项目的陆续投产,竞争将更加激烈。以甲醇及一氧化碳为原料,采用草酸二甲酯脱羰技术生产碳酸二甲酯,发展甲醇下游电解液原料产品不仅可以减少碳排放,还能成为煤化工企业绿色低碳转型发展的重要路径。
1 碳酸二甲酯简介
1.1 碳酸二甲酯性质
碳酸二甲酯(DMC)分子式为C3H6O3,常温下为无色液体,沸点90.1 ℃,熔点4.0 ℃,密度1.069 g/cm3,与水部分混溶,可以与醇、醚、酮等几乎所有的有机溶剂混溶。
DMC是近年来颇受国内外化工界重视的一种新的化工产品,1992 年在欧洲被登录为“非毒性化学品”。DMC具有多种反应性能,可代替剧毒的光气生产聚碳酸酯,替代剧毒的硫酸二甲酯 (DMS)作甲基化剂。同时,它还是一种新型的绿色溶剂,可作为锂离子电池电解液。因此,DMC被誉为“绿色”有机化工产品、有机合成的“新基石”。
1.2 DMC生产工艺
目前DMC生产技术工艺主要有光气法、酯交换法、甲醇氧化羰基化法(包括液相法和气相法)、尿素醇解法和甲醇/CO2直接合成法等。国外有代表性的DMC生产工艺有意大利ENI公司的液相氧化羰基化法、日本宇部公司的低压气相法和美国德士古公司的酯交换法。国内有代表性的DMC生产工艺是华东理工大学的酯交换法[1]。目前国内外DMC生产工艺及其优势比较见表1和表2。
表1 国内外碳酸二甲酯生产方法
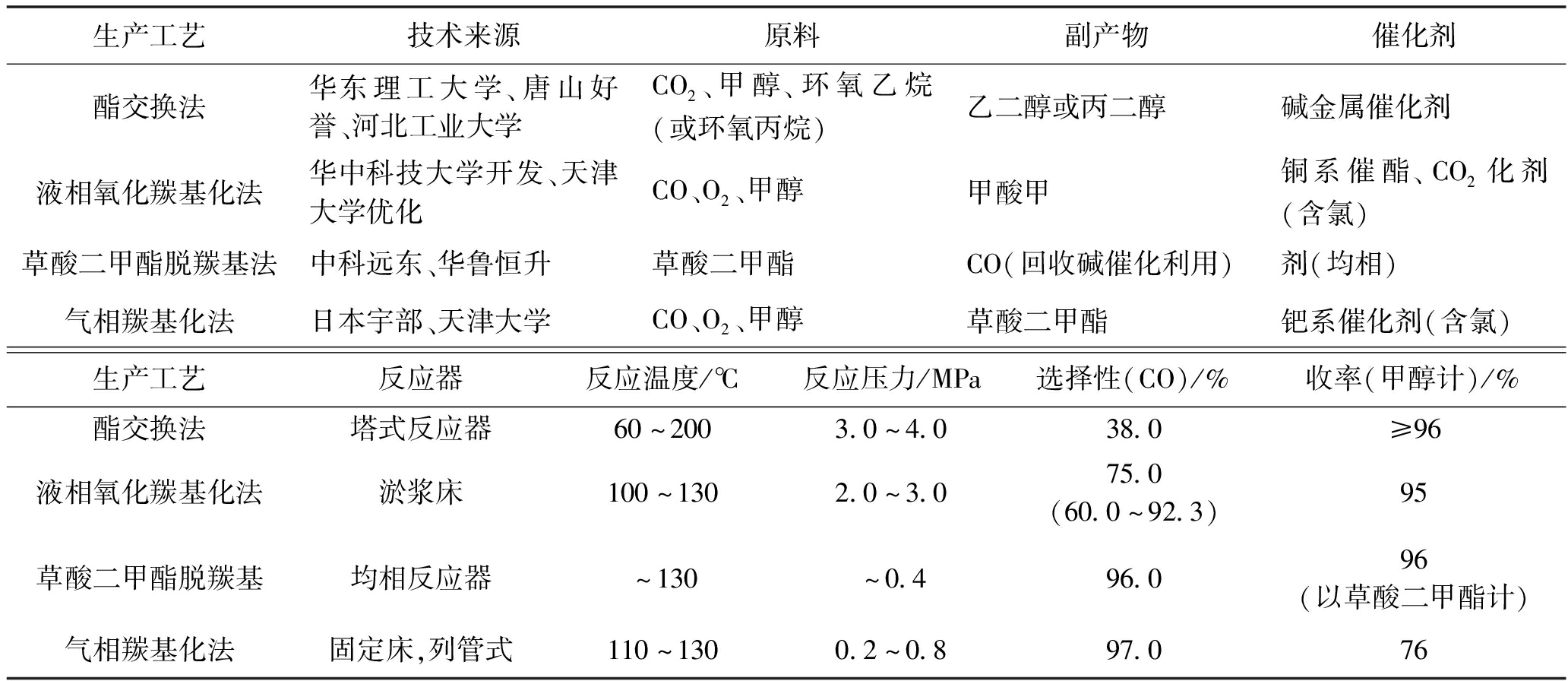
生产工艺技术来源原料副产物催化剂酯交换法华东理工大学、唐山好誉、河北工业大学CO2、甲醇、环氧乙烷(或环氧丙烷)乙二醇或丙二醇碱金属催化剂液相氧化羰基化法华中科技大学开发、天津大学优化CO、O2、甲醇甲酸甲铜系催酯、CO2化剂(含氯)草酸二甲酯脱羰基法中科远东、华鲁恒升草酸二甲酯CO(回收碱催化利用)剂(均相)气相羰基化法日本宇部、天津大学CO、O2、甲醇草酸二甲酯钯系催化剂(含氯)生产工艺反应器反应温度/℃反应压力/MPa选择性(CO)/%收率(甲醇计)/%酯交换法塔式反应器60~2003.0~4.038.0≥96液相氧化羰基化法淤浆床100~1302.0~3.075.0(60.0~92.3)95草酸二甲酯脱羰基均相反应器~130~0.496.096(以草酸二甲酯计)气相羰基化法固定床,列管式110~1300.2~0.897.076
表2 国内外DMC生产工艺优势比较

酯交换法液相氧化羰基化法草酸二甲酯脱羰基法气相氧化羰基化法优势技术成熟可靠、反应条件温和、设备投资低、生产安全性高、收率较高原料价格低廉、易得;装置投资较小,选择性高不含氯,不存在氯腐蚀;装置投资小、催化剂转化率高、选择性好、整体收率高反应在无水条件下进行,长周期运行稳定劣势受原料价格影响大、蒸汽消耗高、生产成本高;单位体积设备生产能力低;EC或PC单元采用甲醇钠催化剂,产生固废;副产物乙二醇或丙二醇,产量大,市场饱和均相催化剂存在Cl-流失问题,使用寿命短、设备腐蚀性大、对设备控制和要求高,存在严重安全风险。采用均相催化剂,需要分离催化剂,催化剂损失大采用钯催化剂,首次催化剂投资高;催化剂含氯,存在氯离子流失问题,需设置专门气相脱氯反应器和液相脱氯反应器,解决产品含氯问题关键技术开发高效催化剂和分离技术开发高效催化剂,减少设备腐蚀开发新型催化剂开发新型催化剂
目前,DMC合成技术正朝着简单化、无毒化和无污染化的方向发展,光气法因存在严重的安全和环保问题已被淘汰,甲醇二氧化碳直接合成法目前还处于基础研究阶段,尿素醇解法也尚处于工业化示范阶段。目前,工业应用的主要为酯交换法(包括环氧丙烷法和环氧乙烷法)和甲醇氧化羰基化法(包括液相法和气相法)。
鉴于现有酯交换法每年产生大量的固废、羰基化法高昂的钯系催化剂,新型高效低成本催化剂及配套工艺开发一直是众多研究院所及企业研发的方向,其中草酸二甲酯(DMO)脱羰生产DMC是新工艺中的方式之一,该工艺可以CO为原料开始设计,也可以DMO为原料开始设计,同时为乙二醇装置柔性生产提供路线,该工艺更适合规模化生产以降低运行成本。预计未来3~5 a,随着DMO脱羰催化剂技术的进一步发展和成熟,与煤化工结合的DMO路线将成为DMC新建或改扩建装置的主流,应用前景广阔。
1.3 主要生产厂家
2022年我国工业级DMC产能130万t/a,主要生产企业有华鲁恒升、浙江石化、石大胜华、中盐安徽红四方、铜陵金泰、海科新源等,新近投产的华鲁恒升与浙江石化超过了传统老牌企业,跃居产能前2位。主要工艺路线及其企业等见表3。
表3 2022年我国工业级DMC生产工艺及其企业
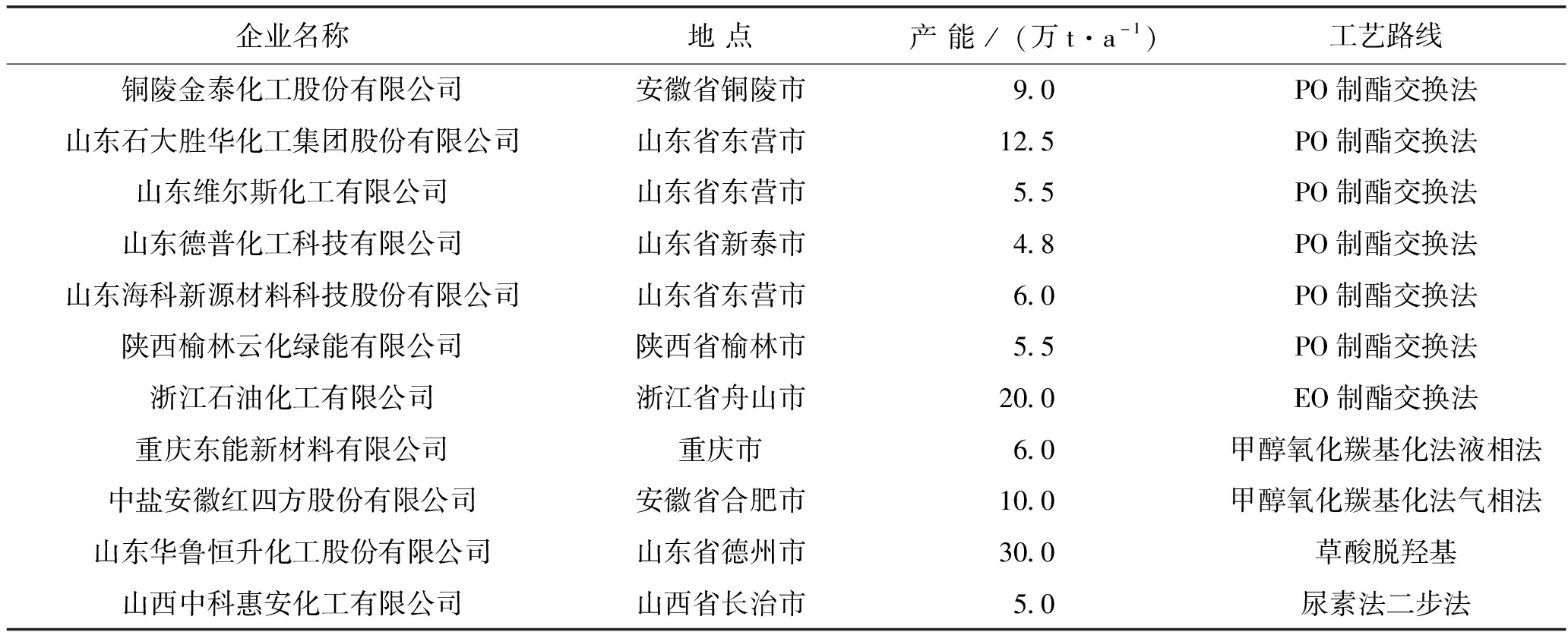
企业名称 地 点产 能 /(万t·a-1)工艺路线 铜陵金泰化工股份有限公司 安徽省铜陵市 9.0PO制酯交换法 山东石大胜华化工集团股份有限公司 山东省东营市 12.5PO制酯交换法 山东维尔斯化工有限公司 山东省东营市 5.5PO制酯交换法 山东德普化工科技有限公司 山东省新泰市 4.8PO制酯交换法 山东海科新源材料科技股份有限公司 山东省东营市 6.0PO制酯交换法 陕西榆林云化绿能有限公司 陕西省榆林市 5.5PO制酯交换法 浙江石油化工有限公司 浙江省舟山市 20.0EO制酯交换法 重庆东能新材料有限公司重庆市 6.0甲醇氧化羰基化法液相法 中盐安徽红四方股份有限公司安徽省合肥市 10.0甲醇氧化羰基化法气相法 山东华鲁恒升化工股份有限公司 山东省德州市 30.0草酸脱羟基 山西中科惠安化工有限公司 山西省长治市 5.0尿素法二步法
2 DMO脱羰催化剂研究
2.1 DMO催化脱羰制备DMC的技术原理
参照DMO脱羰基生成DMC的反应,根据产物的分布,推测的主副反应如下所述。
主反应的反应历程主要是反应物DMO直接脱羰基生成DMC,见式(1):
CH3OOC-COOCH3→CH3OOCOCH3+CO
(1)
副反应的反应历程相对比较复杂,通过研究推测其可能是DMO发生水解,生成乙醇和草酸[2]。由于羧酸在高温下易发生脱羧基反应,因此草酸不稳定。由于草酸中有2个羧基,羧基是电负性较大的吸电子基团,在它的吸电子作用下容易使其另一个羧基离解。因此,草酸在150 ℃发生分解生成甲酸和CO,而DMO脱羰基反应生成DMC的反应温度为200~300 ℃,在此温度下草酸极易发生分解。而分解生成的部分甲酸可能与乙醇发生反应生成甲酸乙酯。另外,甲酸在高温下不稳定,其在160 ℃下就会分解,生成CO和H2O。此时生成的水会进一步促进草酸二乙脂(DEO)的水解,生成更多的乙醇。因此,只要原料或催化剂表面存在少量的水就可能产生相对大量的副产物乙醇,可能发生的反成过程见式(2)~式(4):
CH3OOC-COOCH3+2H2O→2CH3OH+HOOCCOOH
(2)
2HOOCCOOH→2HCOOH+CO2
(3)
HCOOH→CO+H2O
(4)
2.2 脱羰催化剂特点
关于DMO脱羰基催化合成DMC,日本宇部进行了比较详细的研究。他们提出由烷基草酸酯制备烷基碳酸酯的催化剂活性组分,可使用的碱金属化合物包括有机酸碱金属盐、无机酸碱金属盐、碱金属的氢氧化物,碱金属的氧化物,或2种以上的碱金属化合物结合使用。具体的有醋酸盐类、丙酸盐、丁酸盐、甲基草酸盐、草酸盐等有机碱金属盐和一些无机碱金属盐,如硝酸盐、氯化盐、碳酸盐、磷酸盐等化合物[3]。
本实验开发的催化剂是一种新型高端固体碱催化剂,催化剂不含氯,对设备要求比传统催化剂要低的多,可节约制造成本,所得DMC产品也不需要考虑脱氯问题,与气相氧化羰基化法、液相氧化羰基化法所用的贵金属催化剂相比更具经济性。同时,由于目前国内乙二醇生产能力过剩,利用本项目研发的碱催化剂可实现从乙二醇装置的中间产品DMO脱羰直接得到DMC,步骤简易、经济效益好,产生的CO可以循环供给亚硝酸甲酯羰基化制DMO的反应,可望实现100%的原料利用率,本项目开发的催化剂可广泛应用于乙二醇装置转产或联产DMC装置,具有广阔的工业化推广应用前景。
3 新型固体碱催化剂及其反应工艺研究
在前期固体碱催化剂研究基础上,笔者及其团队研究开发出一种新型的固体碱催化剂及配套的反应工艺,用于DMO脱羰制备DMC,并进行了催化剂放大制备技术开发和反应工艺的实验室模拟验证。研究中,对催化剂的组成、结构、活性和稳定性等催化科学基础、催化反应工程基础进行了深入分析。在催化反应动力学研究和反应工艺条件实验室优化的基础上,确定了可用于工业生产的催化剂放大制备和工业成型技术方法。
3.1 新型固体碱催化剂的研究和开发
实验室已经成功开发了无机复合固体碱催化剂系列产品,应用酯交换、羟醛缩合、亲核加成等工业反应过程,对催化剂的结构和表面性能设计积累了较为丰富的经验。针对DMO直接脱羰反应,新型催化剂主要研究载体及其改性助剂的确定,碱性催化活性中心的确定和构建,多组分复合固体碱催化剂制备方法研究,固体碱催化剂的结构和DMO脱羰反应构效关系研究,催化剂稳定性考察及失活因素探索,以及催化剂放大制备和工业成型技术开发等技术。
3.2 DMO制备DMC催化脱羰反应工艺研究
采用釜式间歇反应进行催化剂的评价,并进行连续流动釜式反应系统的构建和工艺参数优化。采用固定床反应装置进行催化剂评价和工艺参数优化,在气-液-固三相(固体催化剂和液体反应物料及溶剂、副产物CO)反应体系中,对不同工艺条件下的传热传质情况进行研究,同时结合本征动力学研究和反应过程模拟计算优化确定了最佳工艺条件。
通过以上2种工艺进行的比选研究,对优选出的工艺路线进行了中试放大模拟设计。
4 催化剂体系及其制备方法研究
在实验研究中,构建了2个催化剂体系进行配方制备方法的优化研究。首先,确定碳酸铯(CsCO3)为主要活性组分;其次,选用三氧化二铝(Al2O3,起始原料为拟薄水铝石)为载体,助剂为镧系元素碳酸盐进行筛选评价;第三,选用二氧化珪(SiO2,起始原料为硅胶微粉)为载体,助剂为碱土金属氧化物进行筛选评价[4]。
在催化剂初步定型方面,标记为BS-CCL或ZA-CCL,主要成分为Cs2CO3,Ce2(CO3)3,La2(CO3)3,BaO或ZnO,SiO2或Al2O3(载体),制备方法和步骤如下所述。
步骤1,过渡金属碳酸盐负载:配制镧和/或铈的可溶性盐水溶液,配制沉淀剂碳酸氢钠溶液,将微米级的活性氧化铝(或微米级二氧化硅)载体放置沉淀槽内,然后以0.7~1.2 mL/min的速率缓慢并流滴加到沉淀槽内,滴加期间调节可溶性盐水溶液和碳酸氢钠溶液的滴加速率控制沉淀,pH值为8~10,滴加期间剧烈搅拌,搅拌速率500~1 000 r/min;滴加完毕后,继续剧烈搅拌老化2~10 h;经抽滤、洗涤、干燥、焙烧后得到改性载体M2/Al2O3。
步骤2,碱金属碳酸盐负载:配制15%~30%(M2/H2O)的碱金属碳酸盐水溶液,等体积浸渍上述改性载体M2/Al2O3,干燥后进行焙烧,得到DMO气相脱羰用催化剂M1-M2/Al2O3。所述步骤1中可溶性盐水溶液为La(NO3)3·6H2O、Ce(NO3)3·6H2O、LaCl3·7H2O、CeCl3·7H2O的1种或多种,可溶性盐水溶液的质量浓度为5 wt%~10 wt%,碳酸氢钠溶液的质量浓度为5 wt%~10 wt%,并流滴加时沉淀槽温度为70 ℃,老化时温度为80 ℃,干燥温度为50~110 ℃、干燥时间为8~12 h,在30%~100% CO2的N2氛围下焙烧,焙烧温度为450~800 ℃,焙烧时间为3~6 h。步骤2中干燥温度为50~110 ℃、干燥时间为8~12 h,在30%~100% CO2的N2氛围下焙烧,焙烧温度为450~600 ℃,焙烧时间为3~6 h。催化剂典型晶相结构如图1和图2所示。
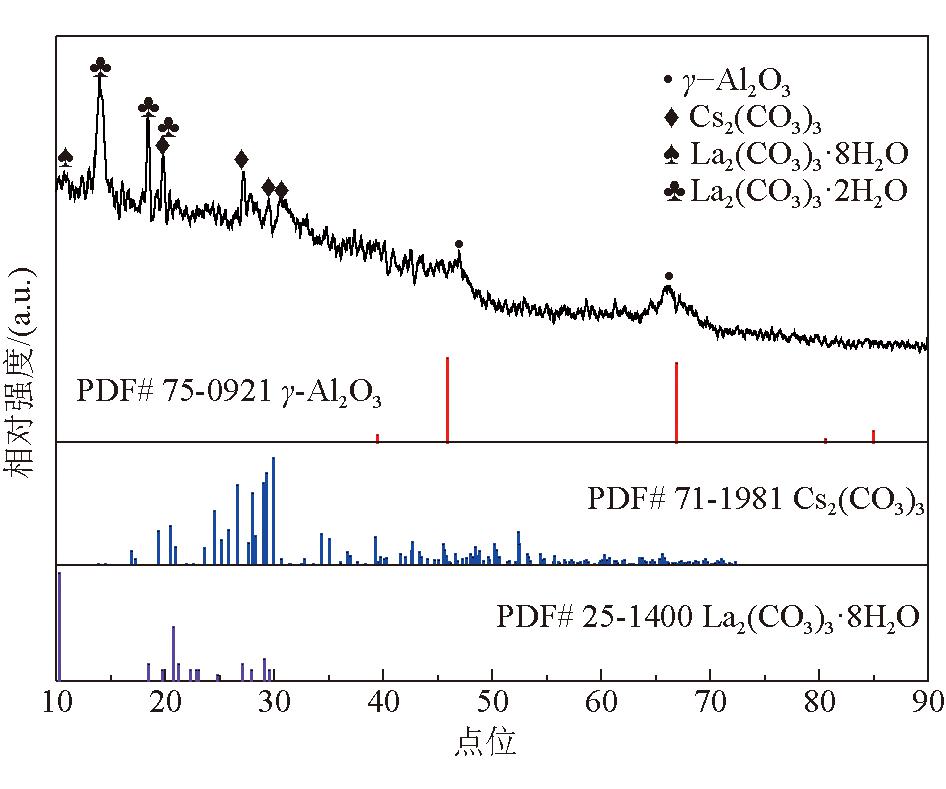
图1 催化剂典型晶相结构
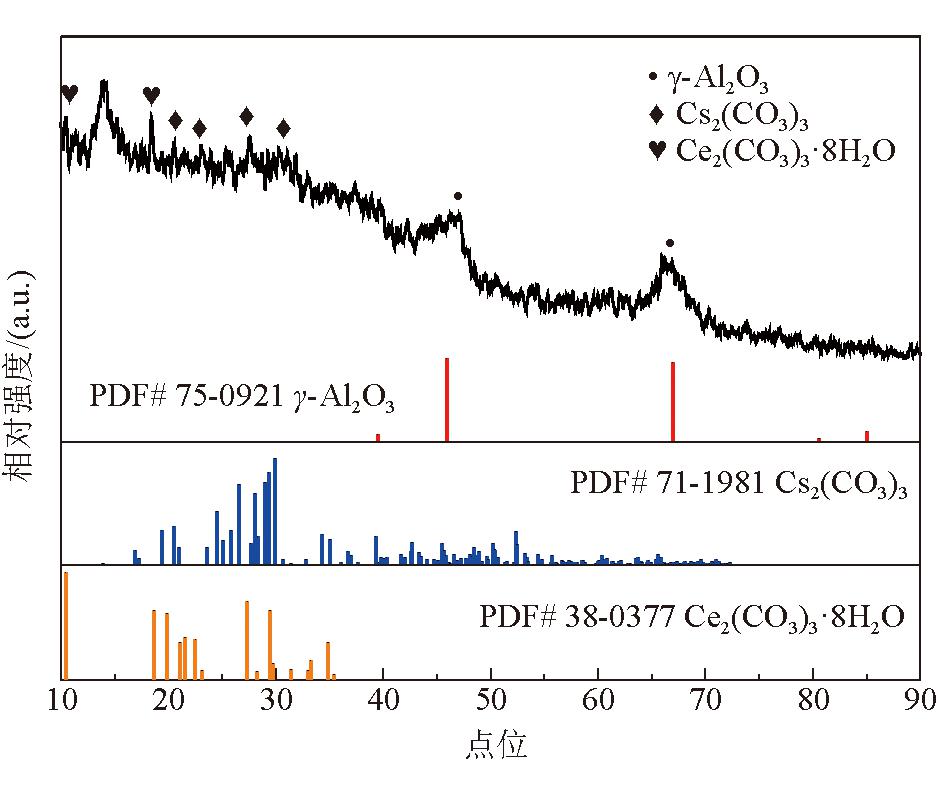
图2 催化剂典型晶相结构
5 实验结果及讨论
5.1 催化剂评价
催化剂评价筛选采用间歇釜式反应器,实验条件为:500 mL密闭反应釜,DMO投料30 g,催化剂用量1.5 g,反应温度160~220 ℃,用这些催化剂生产DMC的转化率和选择性的实验结果见表4。典型色谱分析图谱如图3所示。
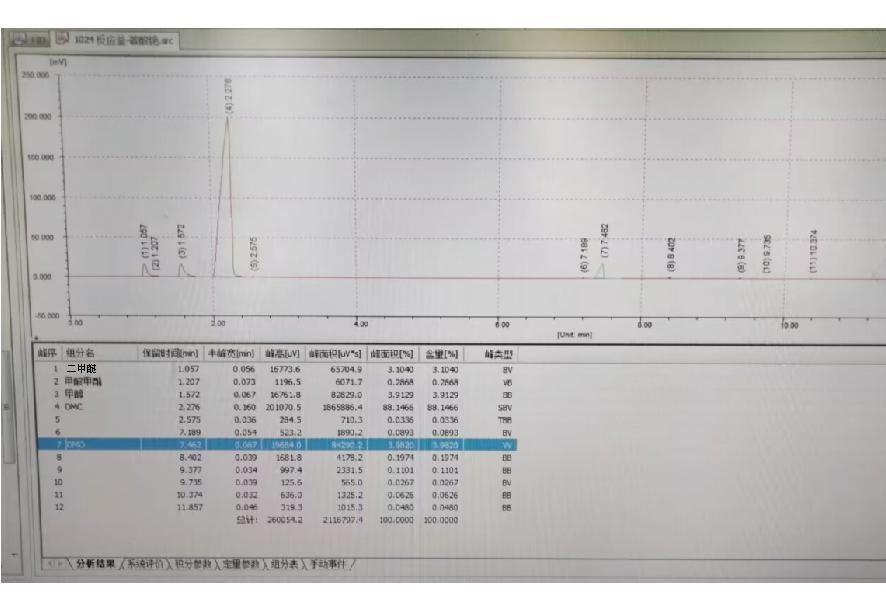
图3 典型色谱分析图谱的实验数据
表4 DMO催化脱羰制备DMC实验结果
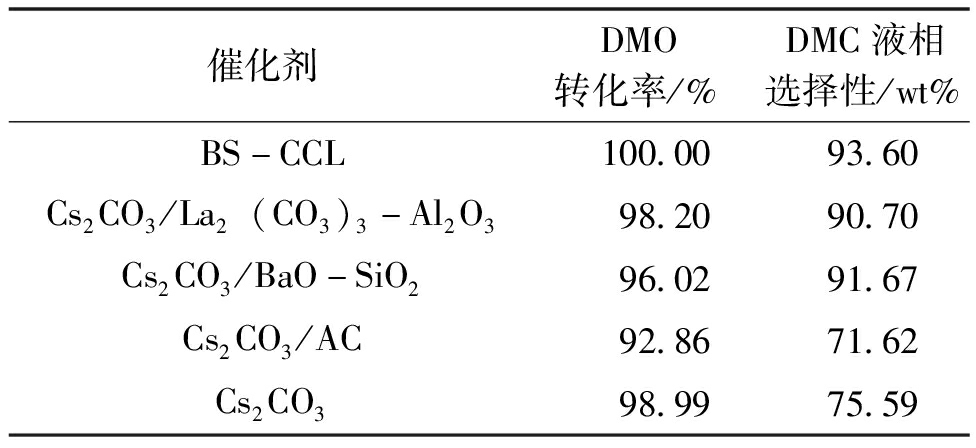
催化剂DMO转化率/%DMC液相选择性/wt%BS-CCL100.0093.60Cs2CO3/La2(CO3)3-Al2O398.2090.70Cs2CO3/BaO-SiO296.0291.67Cs2CO3/AC92.8671.62Cs2CO398.9975.59
从图3液相产物色谱分析典型谱图可以看出主要副产物为甲醇、二甲醚和甲酸甲酯。
对Cs2CO3/BaO-SiO2催化剂体系进行了进一步的优化,主要是制备方法的改进,获得了千克级的稳定载体,负载活性组分后首先在间歇釜式反应系统中进行了重复性实验。催化剂总体性能稳定,表明没有活性组分流失,实验条件为:100 mL密闭反应釜,DMO投料12 g,催化剂用量1.2 g,反应温度200 ℃,实验结果见表5。
表5 Cs2CO3/BaO-SiO2催化剂DMO脱羰制备DMC重复使用实验结果
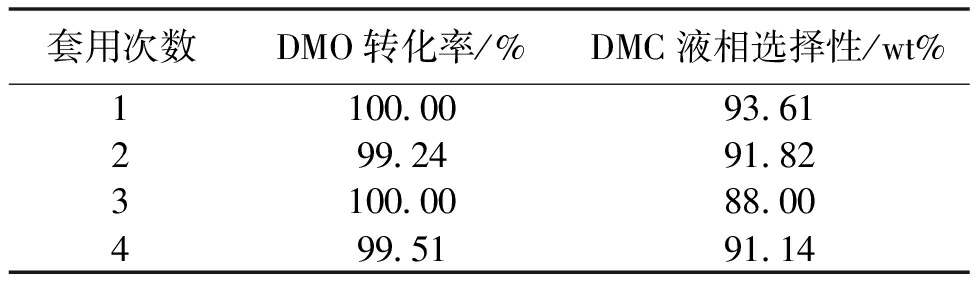
套用次数DMO转化率/%DMC液相选择性/wt%1100.0093.61299.2491.823100.0088.00499.5191.14
采用间歇釜式反应器,BS-CCL型催化剂转化率和选择性均超过90%,达到了预期效果。
5.2 系列催化剂的构建及反应行为研究
5.2.1 以SiO2为载体不同活性组分负载量的系列催化剂评价
以SiO2为载体,不同活性组分负载量的系列催化剂评价结果如图4所示。
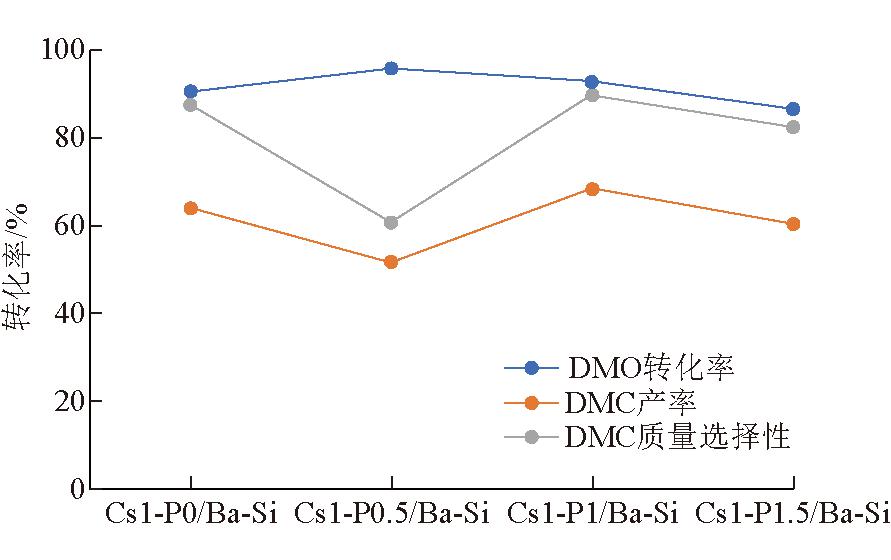
图4 以SiO2为载体不同活性组分负载量的系列催化剂评价结果
5.2.2 不同碱性助剂对Al2O3载体负载Ce和Cs催化剂体系反应
不同碱性助剂对Al2O3载体负载Ce和Cs催化剂体系反应性能的影响见表6。从表6中可以看出不同碱性助剂对Al2O3载体负载Ce和Cs催化剂体系反应性能的影响。
表6 不同碱性助剂对Al2O3载体负载Ce和Cs催化剂体系反应性能的影响
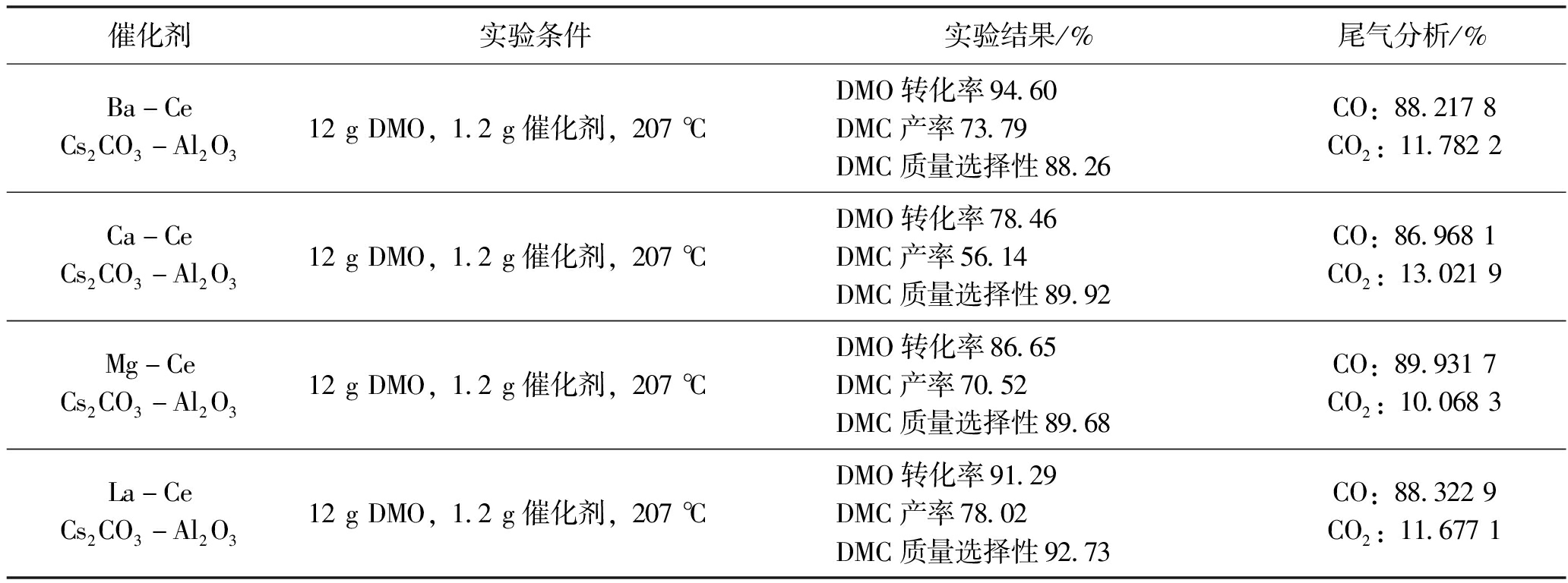
催化剂实验条件实验结果/%尾气分析/%Ba-CeCs2CO3 -Al2O312 g DMO,1.2 g催化剂,207 ℃DMO转化率94.60DMC产率73.79DMC质量选择性88.26CO:88.217 8CO2:11.782 2Ca-CeCs2CO3-Al2O312 g DMO,1.2 g催化剂,207 ℃DMO转化率78.46DMC产率56.14DMC质量选择性89.92CO:86.968 1CO2:13.021 9Mg-CeCs2CO3-Al2O312 g DMO,1.2 g催化剂,207 ℃DMO转化率86.65DMC产率70.52DMC质量选择性89.68CO:89.931 7CO2:10.068 3La-CeCs2CO3 -Al2O312 g DMO,1.2 g催化剂,207 ℃DMO转化率91.29DMC产率78.02DMC质量选择性92.73CO:88.322 9CO2:11.677 1
注:Ba-Ce碱性助剂对催化剂反应性能影响最佳,DMO转化率达到94.60%。
5.3 DMO催化脱羰连续反应工艺探索
采用每批次kg级放大制备的催化剂(BS-CCL),实验室压片成型,破筛颗粒度0.425~0.850 mm;采用200 mL管式固定床加压连续反应系统,反应器内径Φ12 mm,催化剂装填量40 mL。
5.3.1 第1次实验
此次实验中,在220 ℃、3.0 MPa时,样品中DMC含量可以达到80%以上;当降低反应系统压力(从3.0 MPa降至2.5 MPa)后,甲醇含量明显增多,从4.59%提高至27.74%;待提高压力至3.7 MPa后,DMC含量逐步升高可以达到74%左右;压力不变升高温度至240 ℃后,DMC含量大幅度降低(由73.78%降至28.14%)。实验结果见表7。实验数据中的组分占比对DMC来说就是DMC产率,对反应物DMO和生成的副产物来说是组分的占比。
表7 DMO催化脱羰连续反应第1次实验结果(2023年3月27日至4月10日,样品粒度0.425~0.850 mm,40 ml)
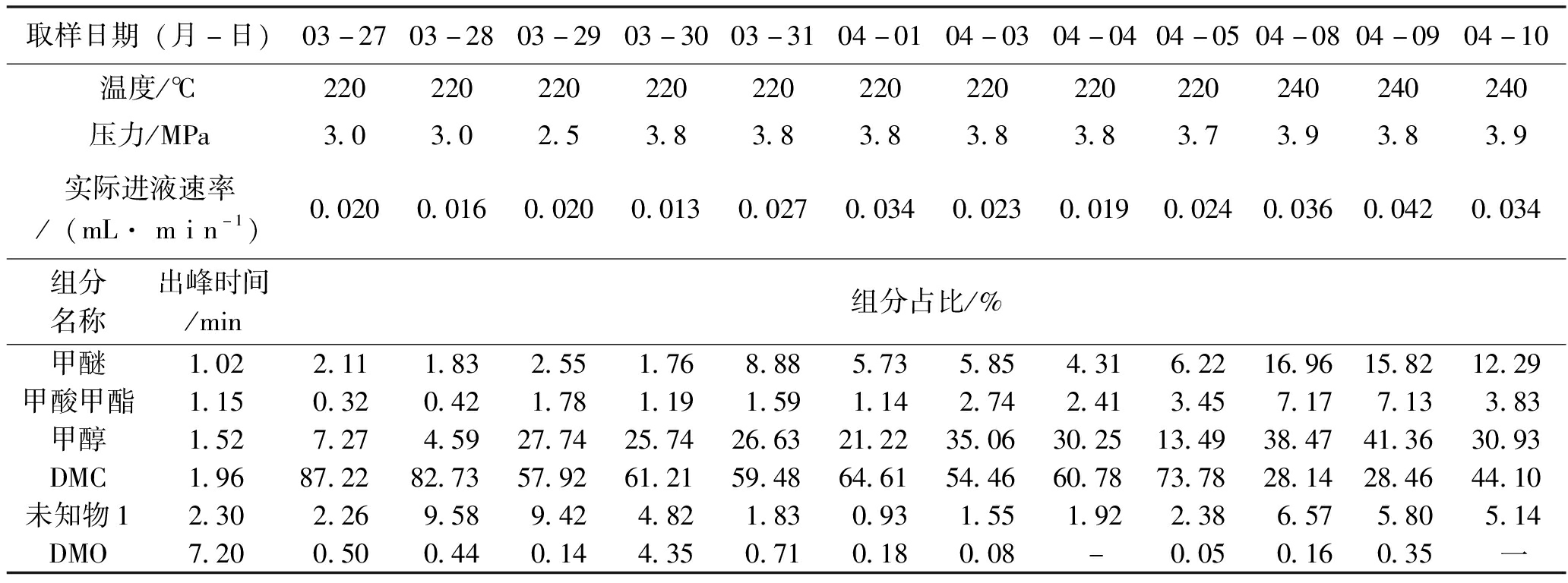
取样日期(月-日)03-2703-2803-2903-3003-3104-0104-0304-0404-0504-0804-0904-10温度/℃220220220220220220220220220240240240压力/MPa3.03.02.53.83.83.83.83.83.73.93.83.9实际进液速率/(mL· m i n-1)0.0200.0160.0200.0130.0270.0340.0230.0190.0240.0360.0420.034组分名称出峰时间/min组分占比/%甲醚1.022.111.832.551.768.885.735.854.316.2216.9615.8212.29甲酸甲酯1.150.320.421.781.191.591.142.742.413.457.177.133.83甲醇1.527.274.5927.7425.7426.6321.2235.0630.2513.4938.4741.3630.93DMC1.9687.2282.7357.9261.2159.4864.6154.4660.7873.7828.1428.4644.10未知物12.302.269.589.424.821.830.931.551.922.386.575.805.14DMO7.200.500.440.144.350.710.180.08-0.050.160.35一
表7实验数据表明,相对高的操作压力,相对低的操作温度更有助于脱羰反应,比如,在3.0 MPa、220 ℃条件下DMC产率最高达87.22%。
5.3.2 第2次实验
此次实验全程在220 ℃、3.8(3.7)MPa下进行,效果较稳定,DMC含量可稳定在80%左右,且未知物1的含量较少,也没有其他未知物。实验结果见表8。
表8 第2次实验DMC转化率及副产物实验数据(2023年4月13-19日,样品粒度0.425~0.850 mm,40 ml)
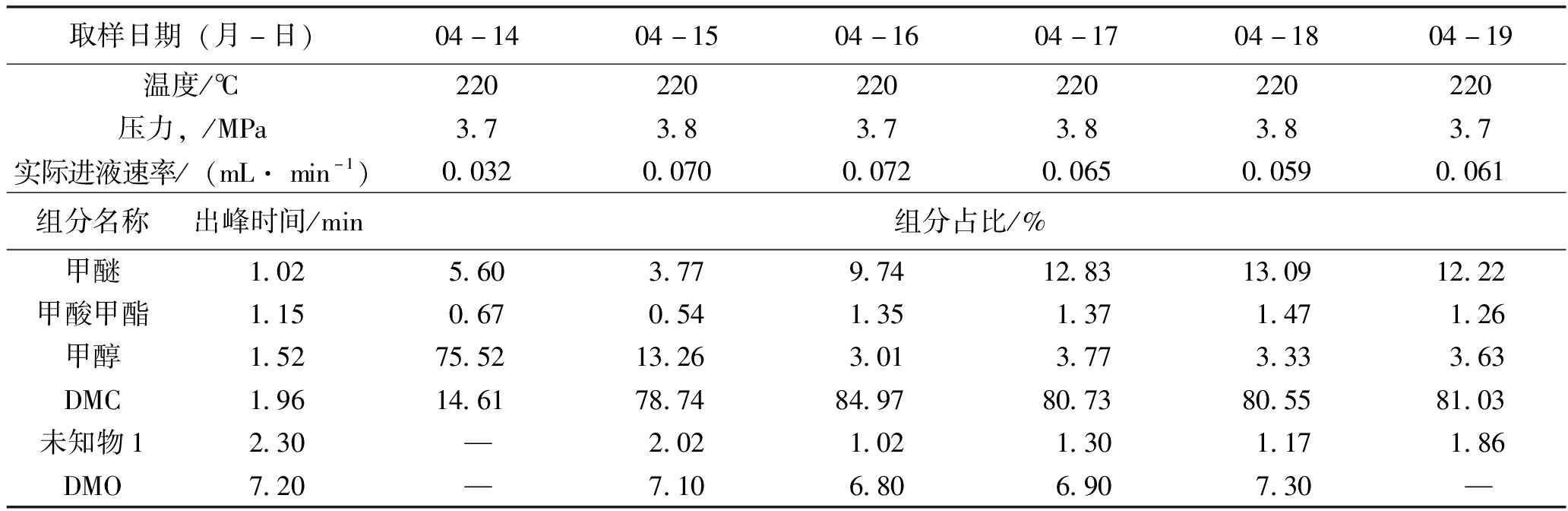
取样日期(月-日)04-1404-1504-1604-1704-1804-19温度/℃220220220220220220压力,/MPa3.73.83.73.83.83.7实际进液速率/(mL· min-1)0.0320.0700.0720.0650.0590.061组分名称出峰时间/min组分占比/%甲醚1.025.603.779.7412.8313.0912.22甲酸甲酯1.150.670.541.351.371.471.26甲醇1.5275.5213.263.013.773.333.63DMC1.9614.6178.7484.9780.7380.5581.03未知物12.30—2.021.021.301.171.86DMO7.20—7.106.806.907.30—
表8实验数据表明,在3.8 MPa、220 ℃条件下,DMC产率最高可达81%左右。
5.3.3 第3次实验
此次实验先在220 ℃、3.7 MPa下进行,效果没有第2次实验效果好,DMC产率最高只有71%左右,后续降低反应压力至2.5 MPa后,DMC产率大幅度降低,副产中甲醇含量略有降低(由28.77%降至15.69%),但未知物3(出峰时间9.3 min左右)的含量明显增多(由0提高至21.23%),在此实验中第一次未知物3的含量这么高,实验结果见表9。
表9 第3次实验DMC转化率及副产物实验数据(2023年4月23至5月6日,样品粒度0.425~0.850 mm,40 ml,31.36 g)
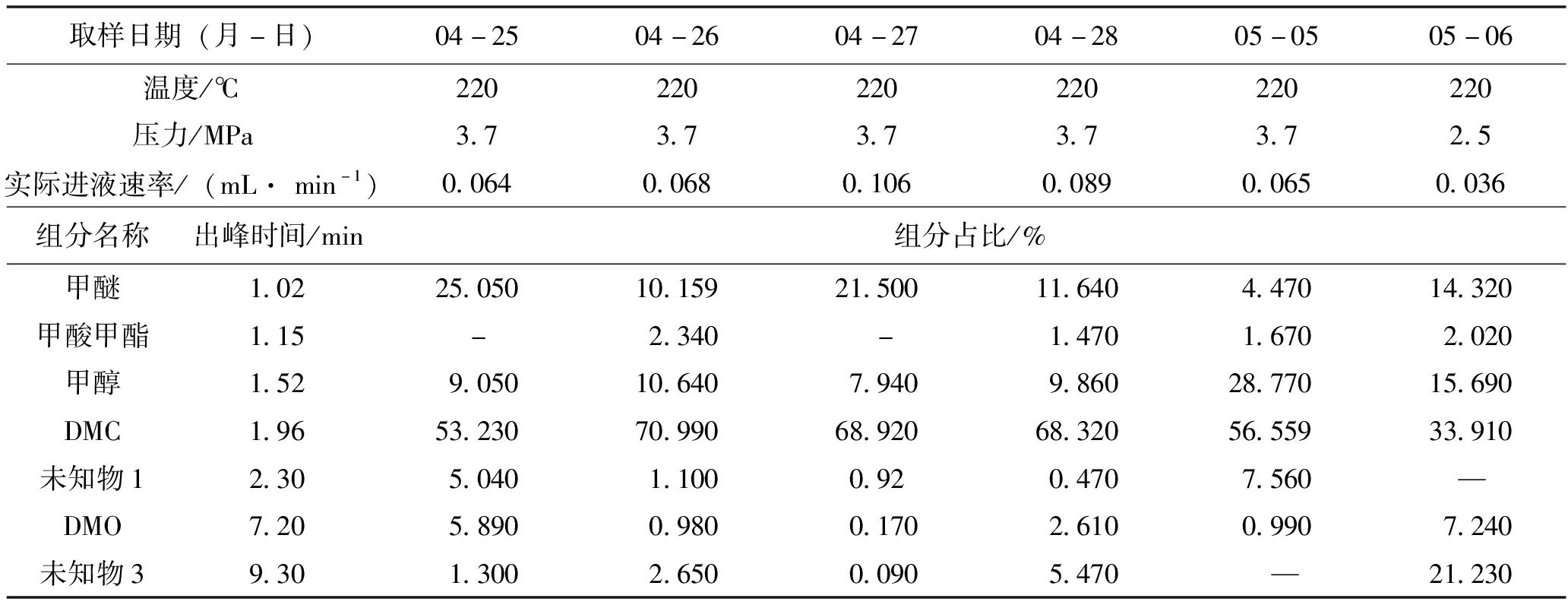
取样日期(月-日)04-2504-2604-2704-2805-0505-06温度/℃220220220220220220压力/MPa3.73.73.73.73.72.5实际进液速率/(mL· min-1)0.0640.0680.1060.0890.0650.036组分名称出峰时间/min组分占比/%甲醚1.0225.05010.15921.50011.6404.47014.320甲酸甲酯1.15-2.340-1.4701.6702.020甲醇1.529.05010.6407.9409.86028.77015.690DMC1.9653.23070.99068.92068.32056.55933.910未知物12.305.0401.1000.920.4707.560—DMO7.205.8900.9800.1702.6100.9907.240未知物39.301.3002.6500.0905.470—21.230
表9实验数据表明,在压力为3.7 MPa、温度为220℃的条件下,DMC产率最高可达71%左右。
5.3.4 第4次实验
此次实验温度稳定在280 ℃,压力为2.4 MPa和2.5 MPa,总体DMC产率较低,甲醇含量偏多,但除未知物1外无其他未知物。实验结果见表10。
表10 第4次实验DMC转化率及副产物实验数据(2023年5月17-21日,样品粒度0.425~0.850 mm,40 ml,33.59 g)
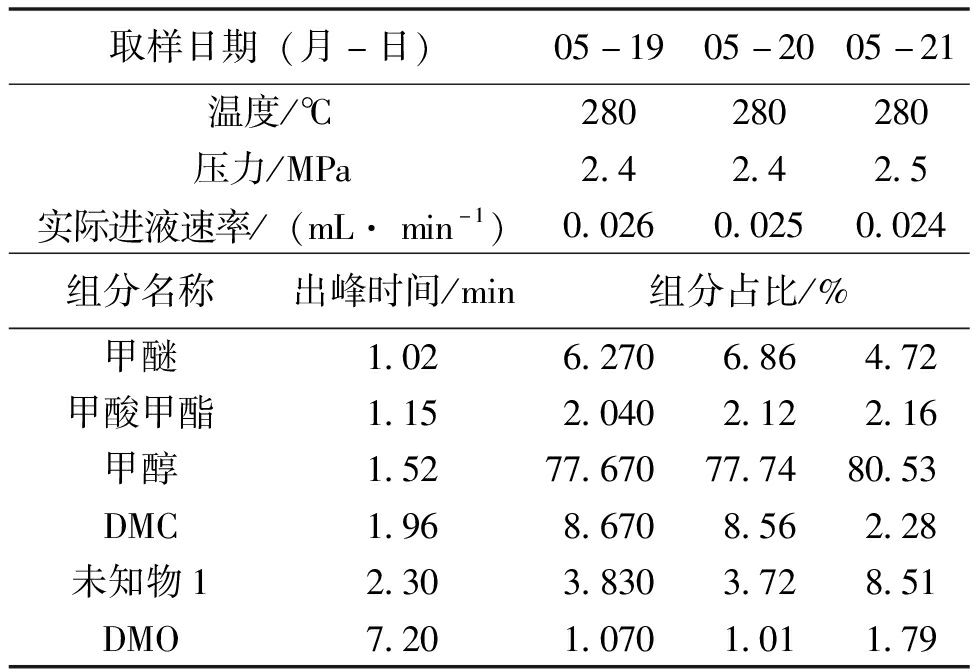
取样日期(月-日)05-1905-2005-21温度/℃280280280压力/MPa2.42.42.5实际进液速率/(mL· min-1)0.0260.0250.024组分名称出峰时间/min组分占比/%甲醚1.026.2706.864.72甲酸甲酯1.152.0402.122.16甲醇1.5277.67077.7480.53DMC1.968.6708.562.28未知物12.303.8303.728.51DMO7.201.0701.011.79
表10实验数据表明,反应温度升高不利于生成DMC的脱羰反应进行,在280 ℃、2.4 MPa的反应条件下,DMC产率只有8.67%和8.56%。
由以上实验数据可以得出,研发的Cs2CO3/BaO-SiO2催化剂在间歇釜式反应工艺中最佳反应温度为200 ℃时DMO转化率≥98%、DMC选择性≥93%;在固定床反应工艺,低温更有利于反应进行,最佳反应温度为220 ℃时DMO的转化率在90%~100%,DMC的选择性为87%左右。
5.4 经济性分析
DMO脱羰基法制DMC采用的碱性催化剂,主要成分为Ba-Ce Cs2CO3-Al2O3,催化剂标记为BS-CCL,由于不使用贵金属钯催化剂,价格低廉,DMC生产成本约为170元/t;酯交换法采用甲醇钠为催化剂,吨产品催化剂消耗0.063 t,产品催化剂成本约为287元/t;液相羰基化法及气相羰基化法采用含氯钯系催化剂,产品催化剂成本约为275元/t。DMO脱羰工艺具有明显的经济性,且由于酯交换法、羰基化法DMO单套基本在5~10万t 规模,DMO脱羰相对可以扩大规模,具备规模效益,其催化剂及配套工艺开发将是重点发展方向。
6 结论
(1)阐述了DMO催化脱羰制备DMC的技术原理,通过对DMO脱羰催化剂及工艺的实验研发,发明了1种含铯固体碱催化剂BS-CCL(已申请发明专利)。
(2)分别进行了间歇釜式、连续固定床2种反应工艺(路线)催化剂的评价筛选、反应工艺条件优化实验研究。
(3)研究结果表明:间歇釜式反应工艺,在反应温度220 ℃,体系自生压力5.2~5.6 MPa时,DMO的转化率为100%,生成DMC的选择性最高可达93.6%;固定床反应工艺,温度180~280 ℃,压力2.0~5.0 MPa时,DMC转化率为90%~100%,生成DMC的选择性最高达81%。在固定床连续状态下,生成DMC的选择性随温度升高而逐渐变差,反应的速率随温度的增加比较明显。
(4)BS-CCL催化剂由于不使用贵金属钯催化剂具有明显的经济性,对煤化工企业的经济效益和减少碳排放具有重要意义。
[1] 刘明丽,张焕仁.碳酸二甲酯的制备方法及关键技术[J].江苏化工,2004,32(2):5.
[2] 张浩洋.固体碱催化剂用于草酸二甲酯脱羰基生成碳酸二甲酯的研究[D].上海:上海师范大学,2016.
[3] 卢惠,张新堂.CeO2催化剂的制备条件对甲醇和二氧化碳合成碳酸二甲酯的影响[J].现代化工,2020,40(2):177-186.
[4] 吴辰亮,李小青,张超,等.Fe-Ce/SiO2固体碱催化剂用于制备碳酸二甲酯[J].化工学报,2020,71(1):297-305.
Study on the catalytic preparation reaction process of dimethyl carbonate from dimethyl oxalate

移动扫码阅读
ZHANG Chengxiang.Study on the catalytic preparation reaction process of dimethyl carbonate from dimethyl oxalate[J].China Coal,2024,50(2):124-131.DOI:10.19880/j.cnki.ccm.2024.02.016
- 相关推荐
